Reduktion von Kupferoxid quantitativ
Das Gesetz von den konstanten Proportionen (Gesetz der konstanten Massenverhältnisse) lässt sich experimentell auf verschiedenste Weise nachweisen. Oft macht man beim Klassiker im Schülerversuch (Bildung von Kupfersulfid) ein längeres Gesicht, weil die Werte nicht besonders gut hinhauen.
Immer funktioniert hingegen der folgende Versuch, auch wenn dieser etwas höhere Ansprüche an den Experimentator stellt und daher nur als Lehrerversuch sinnvoll ist. Dabei wird Kupfer(II)oxid (schwarz) mit Hilfe von Wasserstoff zu elementarem Kupfer und Wasser reduziert gemäß:
CuO + H2 → Cu + H2O
Das Wasser entsteht dabei in gasförmigem Aggregatzustand und „nimmt“ den Sauerstoff dadurch mit, sodass man durch Massenvergleich vor und nach der Reaktion das Massenverhältnis von Kupfer und Sauerstoff in der Verbindung Kupfer(II)oxid bestimmen kann.
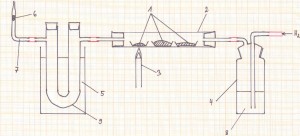
Dazu verwende ich in der Luxusausstattung folgende Apparatur:
Legende:
- Magnesiaschiffchen mit unterschiedlichen Stoffportionsmassen von Kupferoxid
- Reaktionsrohr aus Quarzglas
- Gasbrenner
- Waschflasche
- Wasserbad
- Eisenwolle (locker gestopft)
- gewinkeltes Glasrohr
- Wasser oder Schwefelsäure (konz.) wenn der Wasserstoff getrocknet werden muss
- U‑Rohr
Zunächst wird das Leergewicht aller Schiffchen auf der Feinwaage (d=0,01g) bestimmt. Danach füllt man jedes Schiffchen mit einer anderen Masse an Kupferoxid und wiegt erneut, sodass die Masse des eingefüllten Kupferoxids jeweils bekannt ist. Anschließend werden alle Schiffchen mit einer langen Pinzette in das schon waagerecht eingespannte Reaktionsrohr geschoben und die Apparatur verschlossen. Weiterlesen