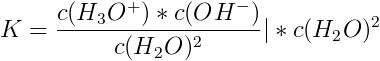Das Ionenprodukt des Wassers
Vorbemerkung:
Alle Formeln in diesem Artikel wurden mit diesem Onlinetool erstellt!
Und jetzt los:
Nach langer Zeit kommt hier endlich wieder etwas Fachliches. Mich nerven seit Jahren Lehrbücher mit einem Satz, der immer wieder in der einen oder anderen Form auftritt. Er lautet:
Wie man leicht sieht…
Entweder ich gehöre nicht zur Spezies „man“, ich bin unbegabt oder einfach zu kritisch. Ich sehe zumindest in den seltensten Fällen die ausgelassenen Zusammenhänge „leicht“. Ein prima Beispiel ist der Kw- bzw. pKw-Wert, also das Ionenprodukt des Wassers. Die meisten Lehrbücher machen das so (oder ähnlich):
In geringem Maße protolysiert Wasser sich selbst. Darauf ist auch die geringe Leitfähigkeit von reinem Wasser zurückzuführen. Die Reaktion verläuft gemäß:
Für diese Reaktion lässt sich die Massenwirkungskonstante K formulieren:
Und jetzt kommt der Satz:
Wie man leicht sieht, kann die Konzentration des Wasser bei verdünnten sauren und basischen Lösungen als weitere Konstante betrachtet und die Konzentration des Wassers mit in die Massenwirkungskonstante K einbezogen werden, indem man beide Seiten mit dem Term c(H2O)2 multipliziert:
also
Da der Term K * c(H2O)2 jetzt gemäß obiger Voraussetzung ein Produkt zweier Konstanten ist, fasst man beides zu einer neuen Konstante Kw zusammen:
Der Wert von 10-14 mol2/L-2 ergibt sich aus der Tatsache, dass reines Wasser einen pH=Wert von 7 aufweist, dort also gilt c(H3O+) = c(OH-) = 10-7 mol/L. So weit so gut. Aber was geschieht eigentlich, wenn man die reale Konzentration des Wassers mit einbezieht? Wie stark weicht dann Kidealisiert (Annahme: Die Konzentration des Wassers ist konstant) dann von Kreal (die Konzentration des Wassers ist nicht konstant) ab?