Sulfatbestimmung – konduktometrisch
Die Grundidee war nicht schlecht: Man nehme sich ein Mineralwasser mit hohem Sulfatgehalt („Sulfatwässer“ – schmecken bitter) – geeignete Marken finden sich z.B. hier – und achtet darauf, dass die Hintergrundleitfähigkeit nicht zu hoch ist. Die Stoffmenge der Sulfationen muss die der übrigen Ionen am besten weit übersteigen, damit die Hintergrundleitfähigkeit dabei keinen Strich durch die Rechnung macht. Dann lässt sich z.B. mit Bariumchloridlösung gemäß
Ba2+ + SO42- → BaSO4↓
das Sulfat quantitativ fällen. Bariumsulfat hat ein sehr, sehr niedriges Löslichkeitsprodukt und findet daher trotz der hohen Giftigkeit von Bariumionen sogar in der Medizin als Kontrastmittel Anwendung.
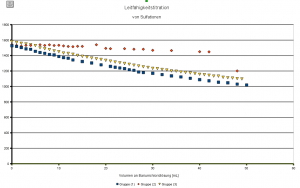
Die Stunde sah dann so aus, dass ich mir ein Sulfatwasser mit 1000mg/L Sulfationen besorgt (äh – ich habe auf die Schnelle eines mit Natriumsulfat und Deionat „gebaut“) und mit den SuS gemeinsam die Konzentration der Maßlösung so eingestellt habe, dass der Aquivalenzpunkt so ungefähr bei 25mL Maßlösungsverbrauch liegt – der Sulfatgehalt stand ja auf der „Flasche“. Folgendes Diagramm kam dabei heraus:
Wie Sie sehen, sehen Sie gar nichts (keine zwei Bereiche mit unterschiedlicher Steigung), obwohl doch das Natriumsulfat als einziges gelöstes Salz vorlag – was war dann nur geschehen?
Antwort: Wer schummelt, wird bestraft – bei kleinen Sünden sofort.
Deionat ist in der Regel sauer. Es wurde von mir aber mit der Absicht verwendet, das Problem der Hintergrundleitfähigkeit – wie es beim „echten Mineralwasser“ vorgekommen wäre – auszuschalten. Dummerweise besitzen Hydroniumionen eine beachtliche Äquivalentleitfähigkeit, die die der übrigen Ionen um ein Vielfaches übersteigt. Und da war sie dann wieder, unsere Hintergrundleitfähigkeit. Bariumsulfat ist bei dem Versuch super ausgefallen. Nur hat wahrscheinlich die Hintergrundleitfähigkeit durch die Hydroniumionen die dadurch aufgetretene Veränderung der Lösung quasi „überstrahlt“.
Fazit:
Nicht schummeln, Mineralwasser vor der Analyse immer abkochen, um Kohlensäure zu entfernen und immer vorher auch vermeintlich „idiotensichere“ Setups ausprobieren. Vorher. Und auch keine Ratschläge von Kollegen zur richtigen Schummeltechnik annehmen.