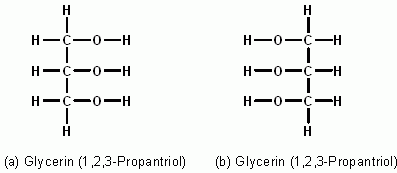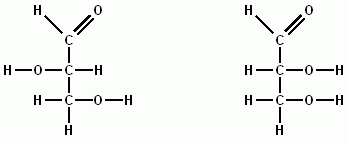Chemische Symbole und Kontexte
Letztens habe ich ja einen Artikel zu Moodle und seinen Kontexten verfasst. Dabei ist mir eine Brücke zur Chemie eingefallen, auch wenn es sich im ersten Moment etwas weit hergeholt anhört. In der Chemie verwendet man ja bekanntlich chemische Symbole, z.B. um Reaktionen in abgekürzter Form zu notieren:
Mg + S → MgS
Die chemischen Symbole sind dabei nicht ganz unkritisch, da sie je nach Kontext unterschiedliche Bedeutung besitzen können. Deswegen vermeide ich sie so lange wie irgend möglich. Uns „Wissenden“ ist diese Kontextabhängigkeit „irgendwie“ klar. SuS dürften damit im ersten Moment so ihre Probleme haben.
Nehmen wir das vermeintlich einfache Symbol S. Je nach Kontext kann es folgendes bedeuten:
- Es steht allgemein für Schwefel (dieses gelbe Pulver), also für den Stoff (Stoffebebene)
- Es steht ebenso für ein einzelnes Schwefelatom (Teilchenebene)
- Es steht auch für eine Atommasse Schwefel - 32u (Massenebene)
- Es kann auch für ein Mol Schwefelatome stehen (Stoffmengenebene)
- Zusätzlich kann es auch für eine molare Masse Schwefel stehen – 32g/mol (Ebene der molaren Masse)
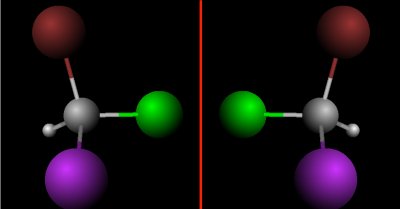
- Um die Verwirrung komplett zu machen, steht es innerhalb einer Formel, z.B. MgS für ein Sulfidion – S2-
- Schlussendlich kann es innerhalb einer Strukturformel auch noch für einen Schwefelatomrumpf stehen
Ich kann SuS schon verstehen, die spätestens in der 11ten Klasse gar nichts mehr begreifen. Fragen Sie im Übrigen einmal Referendare oder Leistungskursschüler danach: Das gibt unter Garantie bei den meisten ganz lange Gesichter.
Wenn man sich dieser kontextabhängigen Bedeutung jedoch bewiusst ist, lässt sich der Unterricht so gestalten, dass bei den SuS ein Bewusstsein für diese Problematik einstellt, die sie befähigt „umzuschalten“. Das ist aber wahrlich nicht leicht und erfordert schon einiges an Brain 2.0.
Glücklicherweise ist das aber analog zu den Moodlekontexten oder dem Erkennen von Ironie (auch sehr schwierig) eine der wirklich netten Herausforderungen des Berufes.