Chemie: Fotometrie mit Kaliumpermanganatlösung
Es gibt Geräte in der Chemiesammlung, um die man als Lehrer einen ehrfurchtsvollen Bogen macht, z.B. eine Gasmolwaage. Für mich gehörte lange Zeit auch das sündhaft teure Fotometer mit dazu, wir besitzen ein Novaspec II mit seriellem Anschluss. Dummerweise steht in diesem Jahr für den Schwerpunktkurs Chemie auf erhöhtem Niveau hier in Niedersachsen das Lambert-Beersche Gesetz auf dem Zettel, sodass man drei Alternativen hat:
- Es als Referat zu vergeben
- Es theoretisch durchzukauen – da gibt es im Netz hervorragende Praktikumsberichte
- In den sauren Apfel zu beißen und es praktisch zu probieren
Ich habe mich mich für die dritte Option entschieden, auch wenn damit die Verbindliche-Abitur-Vorgaben-Macher es damit geschafft haben, Lehrerfortbildung zum Nulltarif zu evozieren.
Ein Kollege ist am vergangenen Freitag extra länger geblieben, um mich in die Geheimnisse dieses Geräts einzuweihen. Glücklicherweise lässt es sich komplett mit einem Laptop fernsteuern – eine Lizenz für die Software AKAnalytik32.NET gibt es an der Schule auch. Mehr braucht es nicht.
Nach einer theoretischen Einführung der SuS in die Grundlagen der Fotometrie habe ich mich für die Untersuchung von Permanganatlösungen entschieden und das aus mehreren Gründen:
- Wässrige Redoxsysteme kann man sowieso nicht genug üben
- Kaliumpermanganat lässt sich auch zur Gewässeranalyse trefflich einsetzen zur Bestimmung des Anteil an oxidierbaren Substanzen und unser Haupthema ist die Gewässeranalyse (didaktische Integration/Kombination möglich)
- Permanganatlösung haben über eine recht breiten Spektralbereich eine brauchbar hohe Extinktion – da kann man nicht viel falsch machen
- Auch sehr niedrigkonzentrierte Lösungen c(KMnO4) = 0,001mol/L haben schon satt Farbe, woran sich die Empfindlichkeit des Verfahrens zeigen lässt
Die Stunde sah folgendermaßen aus (das Prinzip der Fotometrie war den SuS bereits bekannt):
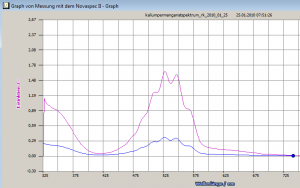
Schritt 1: Aufnahme eines Vollspektrums zur Bestimmung einer geeigneten Wellenlänge für die Messung
Das ist mit der Kappenberg-Software supersimpel. Das Spektrum sah so aus: