Luftanalyse über Brenndauer
Ich habe heute nach üblicher Vorbereitung Versuchsaufbauten ersinnen lassen, die dazu dienen sollen, den Sauerstoffanteil in der Luft zu bestimmen. Normalerweise macht man das z.B. dadurch, dass man in einer geschlossenen Apparatur Sauerstoff durch ein Metall als festes Metalloxid bindet – das geht z.B. mit Kupfer- aber auch mit Eisenwolle – und nach Abkühlung die Volumenabnahme ermittelt – soweit nichts Aufregendes, oft im Unterricht gemacht.
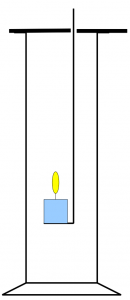
Eine Schülerin schlug heute ein anderes Verfahren vor: Man nehme eine brennende Kerze, stelle sie in ein abgeschlossenes Gefäß mit Luft und messe die Zeit bis zum Erlöschen. Den Versuch wiederhole man mit reinem Sauerstoff. So müsste man mit dem reinen Sauerstoff als Bezugsgröße den Sauerstoffanteil der Luft bestimmen können. So ein Aufbau ist mit Standzylinder, Schliffdeckel, Verbrennungslöffel und der Sauerstoffflasche schnell realisiert:
Hm. Die Idee ist als Denkmodell sehr nett, gerade in einer 8. Klasse. Eine Kerze verbraucht nicht den gesamten zur Verfügung stehenden Sauerstoff, sondern erlischt bei Unterschreitung einer bestimmten Sauerstoffkonzentration. Das ist für das Gelingen des Versuches nicht so tragisch, da das auch im Falle des reinen Sauerstoffs bei der gleichen Konzentration geschieht. Die höhere Reaktionsgeschwindigkeit beim reinen Sauerstoff könnte der Schülerin die Suppe versalzen.
Egal. Ich tue es nächste Woche einfach und dann vergleichen wir das Ergebnis des „klassischen Versuches“ mit dem hier skizzierten. Diese Schülerin hat gedacht und das ist den Aufwand allemal wert.