Die Faradaysche Konstante bestimmen
Manchmal bin ich mir selbst so unheimlich, dass ich gar nicht glauben kann, was ich da eigentlich im Unterricht mit dem zur Verfügung stehenden Material messe. Von irgendwoher habe ich ein Praktikumsscript, in dem die Faradaysche Konstante experimentell mit einem Hoffmannschen Zersetzungsapparat bestimmt wird. Zunächst aber ein bisschen Grundlagen zum Warmwerden.
Das erste Faradaysche Gesetz sagt nichts anderes, als das die bei einer Elektrolyse abgeschiedene Stoffmenge n proportional zur elektrischen Ladung Q ist, die durch den Elekrolyten fließt – mathematisch ausgedrückt:
(1) Q ∼ n
Proportionalitäten haben es so an sich, dass sie über einen Proportionalitätfaktor miteinander verknüpft sind, im Falle des Faradayschen Gesetzes gilt hier:
(2) Q = n * z * F
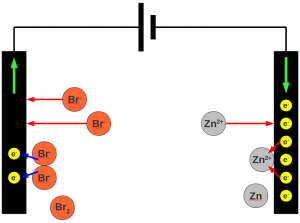
n ist die Stoffmenge, z ist die Anzahl der bei der Elektrolyse pro Ion ausgetauschten Elektronen und F ist Faradaysche Konstante, die wir haben wollen. z bekommen wir nahezu eliminiert, wenn wir in einem System arbeiten, in dem nur ein Elektron ausgetauscht wird, etwa bei der Reduktion von Protonen:
(3) H+ + e- → H
Mit z = 1 bleibt von Gleichung (2) nur noch:
(4) Q = n * F oder Q = F * n
Das sieht schon sehr nach einer Geradengleichung aus:
(5) y = m * x
wobei m die Steigung ist. Also muss ich nur Q in Abhängigkeit von n bestimmen und die Steigung dieser Geraden sollte dann F sein. So der Plan.